Recerca
La Gerència Territorial ICS Lleida, Alt Pirineu i Aran – Gestió de Serveis Sanitaris ha donat sempre una especial importància a la interrelació existent entre qualitat assistencial, docència i recerca, i per tant de l'impacte que la recerca suposa sobre la societat a la que serveix. A més, és important considerar el repte particular de l’Hospital Universitari Arnau de Vilanova com a hospital de referència del territori.
Actualment, part de l’activitat investigadora s’articula mitjançant l’acord de col•laboració amb diverses Fundacions per a la recerca. A destacar, La Fundació Institut Universitari per a la recerca a l'Atenció Primària de Salut Jordi Gol i Gurina (IDIAPJGol) i l'Institut de Recerca Biomèdica de Lleida (IRBLleida).
La Fundació Institut Universitari per a la recerca a l'Atenció Primària de Salut Jordi Gol i Gurina (IDIAPJGol) és un centre de referència en la recerca i la promoció de la salut al primer nivell assistencial que té com a objectiu impulsar i desenvolupar la innovació, la recerca clínica, epidemiològica i en serveis de la salut en l’àmbit de l’atenció primària, i oferir formació amb la finalitat de generar coneixements, difondre resultats i traslladar-los a la pràctica clínica per aportar eficiència al sistema sanitari i promoure i millorar la salut de les persones.
L'IRBLleida sorgeix d’un acord de col•laboració entre l’Institut Català de la Salut (ICS), la Fundació Dr. Pifarré i la Universitat de Lleida (UdL) amb la finalitat de crear sinèrgies entre la recerca bàsica, la clínica i l’epidemiològica que es duia a terme a la regió de Lleida.
Les àrees de major producció científica en aquests centres són l’oncologia mèdica, neurologia, nefrologia, l’àrea de salut mental, cirurgia general i digestiu, pediatria i medicina interna, a part de la recerca associada a la medicina de família.
Activitats de Recerca
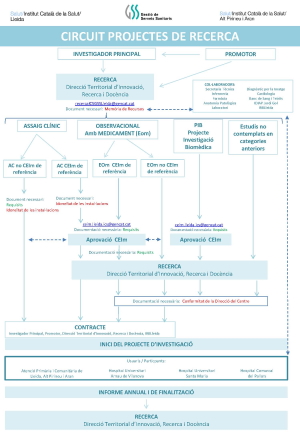
Documents de Recerca
- Participació en projectes competitius

- Afiliació dels autors en les publicacións cientifíques

- Infografia de les afiliacions

- Memòria de recursos. Laboratori mostres animals


- Memòria de recursos. Document intern per obtenir Idoneïtat de les Instal·lacions i/o Conformitat de la Direcció del Centre

- Memòria de projecte de recerca HUAV

- Plantilla pòster HUAV
 i Atenció Primària
i Atenció Primària 
- Model Full d'Informació al Pacient - Consentiment Informat

- Participació en projectes competitius
Comitè d’Ètica d’investigació amb medicaments (CEIm) de l’Hospital Universitari Arnau de Vilanova de la Gerència Territorial de Lleida – GSS
Missió
Aquest CEIm te com a missió vetllar per la protecció dels drets, seguretat i benestar dels éssers humans que participen en projectes de recerca que els hi puguin comportar algun risc físic o psicològic i donar garantia pública, avaluant la correcció metodològica, ètica i legal d’aquests projectes i fent el seguiment de la seva realització als centres inclosos en el seu àmbit d’actuació.
Funcions
Avaluar aspectes metodològics, ètics i legals dels estudis clínics amb medicaments o productes sanitaris i emetre el dictamen corresponent.
Avaluar les modificacions substancials dels estudis clínics autoritzats amb medicaments o productes sanitaris i emetre el dictamen corresponent.
Avaluar els aspectes metodològics, ètics i legals dels estudis post autorització amb medicaments (EPAs).
Avaluar els aspectes metodològics, ètics i legals dels estudis farmacogenòmics i farmacogenètics.
Avaluar els aspectes metodològics, ètics i legals dels projectes d’investigació biomèdica.
Realitzar un seguiment, com a mínim un cop l’any, dels estudis clínics amb medicaments o productes sanitaris, i de la resta de projectes avaluats pel CEIm des de l’inici fins a la recepció del informe final.
Actuar com a Comitè d’Ètica extern del BIOBANC IRBLleida. I, en concret, avaluar la cessió i incorporació de mostres segons estableix l’article 69 de la Llei d’investigació biomèdica i l’article 34 del Real Decreto 1716/2011.
Requisits CEIm i models de documents
- Requisits CEIm de referència

- Requisits contracte assajos clínics

- Requisits estudis post-autorització (EPA)

- Requisits Estudis Observacionals amb medicament (EOm)

- Requisits estudis d’investigació biomèdica

- Sol·licitud avaluació Treball de Fi de Grau / Treball de Fi de Màster

- Memòria de recursos. Document intern per obtenir Idoneïtat de les Instal·lacions i/o Conformitat de la Direcció del Centre

- Idoneïtat de les instal·lacions

- Compromís del Investigador

- Conformitat del Cap de Servei

- Sol·licitud d’emissió de factura – Taxes CEIm. català
 - castellano
- castellano  - english
- english 
- Memòria de projecte de recerca Protocol CEIm

- Requisits CEIm de referència
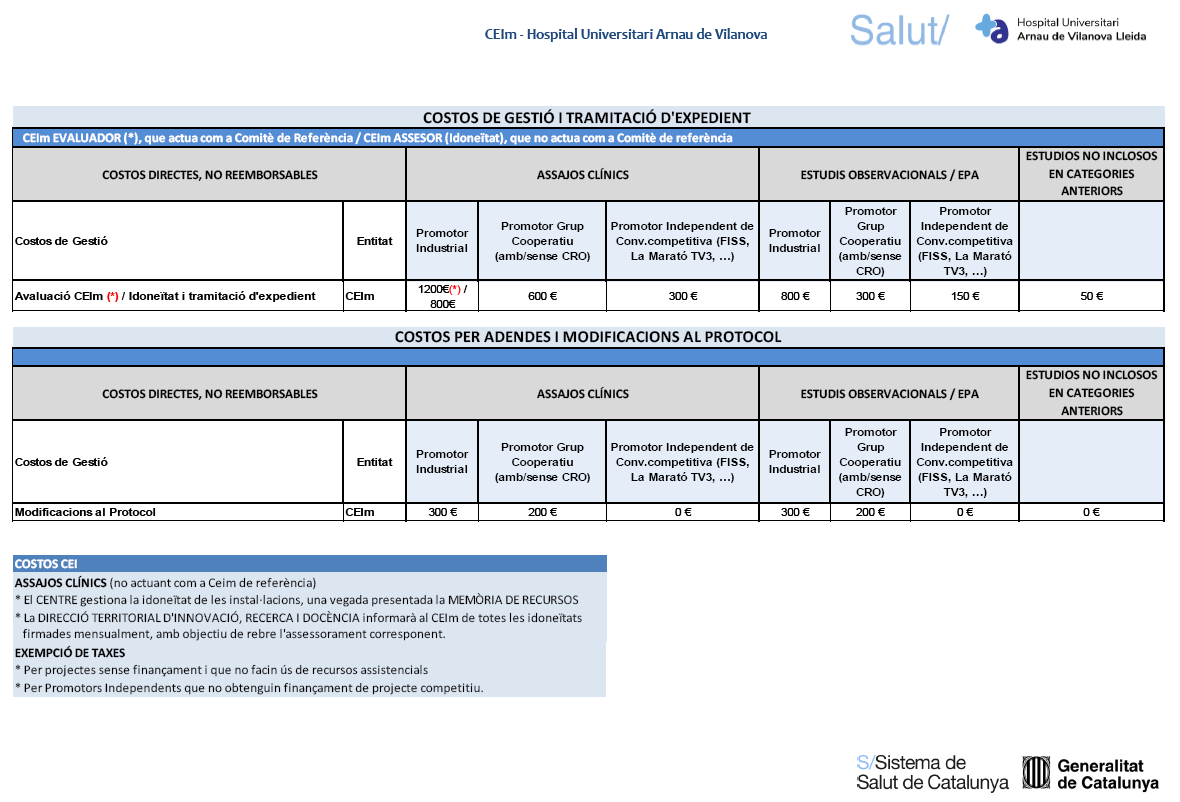
Taxes CEIm
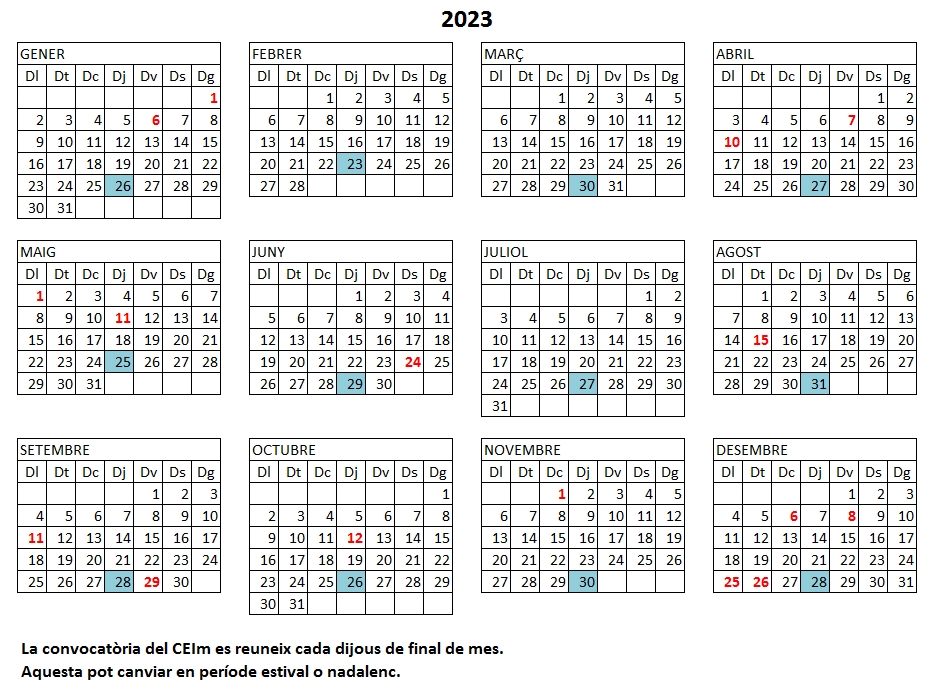
Calendari Reunions
Contacte
Recerca - Direcció Territorial Innovació, Recerca i Docència
Telèfon: 667 04 52 45
Correu electrònic: recercaICSGSSLleida@gencat.catCEIm
Telèfons: 973 70 52 14 extensió 5236 - 663 84 03 28
Correu electrònic: ceim.lleida.ics@gencat.cat
Normativa
- Real Decret 957/2020, de 3 de novembre, pel quan es regulen els estudis observacionals amb medicament d’ús humà

- Instrucció 1/2017 sobre el procediment d’acreditació dels comitès d’ètica d’investigació clínica com a comitès d’ètica d’investigació amb medicaments procedent del Decret 406/2006, de 24 d’octubre de la Generalitat de Catalunya, pel qual es regulen els requisits i el procediment d’acreditació dels Comitès d’Ètica d’investigació clínica
- Reial Decret 1090/2015, de 4 de desembre, pel qual es regulen els assaigs clínics amb medicaments, els Comitès d’Ètica d’investigació amb medicaments i el Registre espanyol d’estudis clínics.
- Reglament (UE) núm. 536/2014 del Parlament Europeu i del Consell de 16 d’abril de 2014 sobre els assaigs clínics de medicaments d’ús humans.
- Reial decret 1716/2011, de 18 de novembre, pel qual s’estableixen els requisits bàsics d’autorització i funcionament dels biobancs amb finalitats d’investigació biomèdica i del tractament de les mostres biològiques d’origen humà, i es regula el funcionament i organització del Registre Nacional de Biobancs per a investigació biomèdica.
- Ordre SAS/3470/2009, de 16 de desembre, per el que es publiquen les directrius sobre estudis posautorització de tipus observacional per a medicaments d’ús humà.
- Llei 14/2007, de 3 de juliol, d’investigació biomèdica.
- Llei 29/2006, de 26 de juliol, de garanties i ús racional dels medicaments i productes sanitaris.
- LEY 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
Fitxes sobre protecció de dades/ dades anonitmitzades en recerca
- Annex 1. Supòsits d'ús de dades per recerca (Fitxa 4)

- Fitxa 3. Dada Personal, Anonimitzada, Pseudonimitzada i Codificada

- Fitxa 5. Contingut del protocol de recerca

- Avaluació d’impacte de protecció de dades (AIPD)


- Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
- Reglament (UE) 2016/679 del Parlament i del Consell, de 27 d'abril de 2016, relatiu a la protecció de les persones físiques pel que fa al tractament de dades personals i a la lliure circulació d'aquestes dades i pel qual es deroga la Directiva 95/46/CE (Reglament general de protecció de dades)
- Real Decret 957/2020, de 3 de novembre, pel quan es regulen els estudis observacionals amb medicament d’ús humà
Enllaços d'interès
©Informàtica TICs Gerència Territorial Lleida. Tots els drets reservats. Avís Legal